

Понимание двойного электрического слоя и его роли в процессе коагуляции частиц
В процессе водоподготовки и водоочистки важное место занимает коагуляция — процесс объединения мелких коллоидных частиц в крупные агрегаты, что способствует их последующему осаждению и удалению. Одним из ключевых факторов, влияющих на коагуляцию, является наличие и структура двойного электрического слоя (ДЭС) вокруг частиц. Двойной электрический- это один из фундаментальных аспектов коллоидной химии, который имеет важное значение для понимания поведения коллоидных систем. Возможность управлять ДЭС позволяет оптимизировать процессы очистки воды, повышая их эффективность.
Двойной Электрический Слой
Природа и Структура ДЭС
Двойной электрический слой формируется на границе раздела фаз, например, на поверхности коллоидных
частиц, погруженных в электролитный раствор, в результате взаимодействия заряженных коллоидных частиц с
молекулами воды. Вода будучи полярной молекулой (из-за разницы в электроотрицательной атомов кислорода и
водорода) имеет возможность притягиваться к заряженной частице электролита. Кроме воды в растворе также
присутствуют противоположные по заряду частицы электролитов, которые вместе с водой формируют двойной
электрический слой.
ДЭС состоит из двух слоев:
1. Слоя Гельмгольца (или адсорбционный слой) — это слой ионов, непосредственно адсорбированных на
поверхности частицы. Эти ионы обычно противоположны по знаку заряда самой частицы.
2. Диффузионного Слоя — это слой ионов, распределенных в окружающем растворе, где их концентрация
уменьшается по мере удаления от поверхности частицы. Ионы в этом слое подвижны и находятся в равновесии
с окружающим раствором.
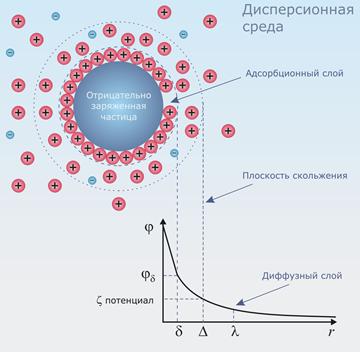
Электрический потенциал на границе этих слоев называется дзета-потенциалом (ζ-потенциалом). Он является важной характеристикой, определяющей устойчивость коллоидной системы.
Коагуляция Частиц
Механизм Коагуляции
Коагуляция происходит, когда коллоидные частицы, обладающие электрическим зарядом, начинают объединяться
в результате снижения электростатического отталкивания между ними. Основными способами достижения этого
являются:
Нейтрализация Зарядов — добавление коагулянтов, которые нейтрализуют поверхностный заряд частиц,
снижая дзета-потенциал. Примеры коагулянтов включают соли металлов, такие как хлорид алюминия или
сульфат железа.
Снижение Толщины ДЭС — увеличение ионной силы раствора приводит к сжатию диффузионного слоя, что
уменьшает отталкивание между частицами.
Взаимосвязь ДЭС и Коагуляции
Роль Дзета-Потенциала
Дзета-потенциал определяет степень электростатического отталкивания между коллоидными частицами. Высокий
дзета-потенциал указывает на значительное отталкивание, препятствующее коагуляции. Снижение
дзета-потенциала способствует приближению частиц друг к другу и их последующему объединению.
Эффект Коагулянтов на ДЭС
При добавлении коагулянтов к системе происходит адсорбция коагулянтов на поверхности частиц, что ведет к
нейтрализации их зарядов. Это уменьшает дзета-потенциал и сжимает диффузионный слой, способствуя
взаимодействию частиц и их агрегации (по-другому, их слипанию).
Сжатие Диффузионного Слоя
Увеличение концентрации электролитов в растворе приводит к сжатию диффузионного слоя, что уменьшает
расстояние, на котором частицы испытывают взаимное отталкивание. Это позволяет частицам подойти ближе
друг к другу и взаимодействовать, что и вызывает коагуляцию.
Заключение
Двойной электрический слой играет ключевую роль в коагуляции коллоидных частиц в водных системах. Понимание его структуры и влияния на взаимодействие частиц позволяет эффективно управлять процессами коагуляции. Нейтрализация зарядов и сжатие диффузионного слоя посредством добавления коагулянтов являются основными методами контроля этого процесса. Эти знания применяются в водоподготовке и водоочистке для повышения эффективности удаления коллоидных загрязнений и улучшения качества воды.
