

Независимо от источника воды, будь то открытый источник или глубинная скважина, в воде всегда присутствуют растворенные соли минералов. Их суммарное количество определяет солевой состав воды и влияет на ее электропроводность, а содержание ионов кальция и магния обуславливают жесткость воды. Другими словами, жёсткость воды — это совокупность химических и физических свойств, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом кальция, магния (так называемых солей жёсткости).
Измеряется данный показатель согласно ГОСТ 31865-2012 в градусах Жесткости (°Ж). 10 °Ж = 1 мг-экв/л металлов. Эквивалент кальция равен примерно 20, а магния 12, рассчитать его можно разделив молекулярную массу элемента на его валентность (или в случае сложных ионов, на заряд).
Мы выяснили, что вода с большим содержанием солей называется жёсткой, с малым содержанием — мягкой. Термин «жёсткая» по отношению к воде исторически сложился из-за свойств тканей после их стирки с использованием мыла на основе жирных кислот — ткань, постиранная в жёсткой воде, более жёсткая на ощупь. Этот феномен объясняется, с одной стороны, сорбцией тканью кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки на макроуровне. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне. Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2, и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Соль в подземные водные артерии попадает с растворением контактирующих пород. Вода, проходя через толщу земли, вымывает содержащиеся в минералах различные катионы и анионы. Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и даже в бытовых приборах. В то же время использование слишком мягкой воды может приводить к коррозии труб, так как в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием и соотношением содержания различных солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Согласно СанПин РК 3.02.002.04. Жесткость питьевой воды установлена в пределах до 7 мг-экв/л, однако оптимальные значения исходя из нашего опыта около 2-3 мг-экв/л. Употребление же обессоленной воды в пищу считается неблагоприятным по той причине, что нарушается солевой баланс организма.
Способы удаления жесткости из воды
Устранение избыточной жёсткости воды зачастую является одним из этапов водоподготовки.
Наиболее популярный метод, применяемый чаще всего это умягчение при помощи напорных фильтров. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж.
Другим не менее часто используемым методом, позволяющим также снизить общее солесодержание воды и ее электропроводность является обратноосмотическое обессоливание. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %.
Однако это наиболее дорогой выбор. В качестве других недостатков данного метода следует отметить:
• необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану;
• относительно высокая стоимость 1 л получаемой воды (дорогое оборудование, дорогие мембраны);
• в некоторых случаях объем сливных стоков может быть достаточно высок.
Третьим методом стоит указать электродиализ. Он основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Еще один метод для удаления жесткости это термоумягчение. Основан на кипячении воды, в результате термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи:
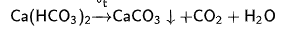
Однако кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту.
Метод используемый наиболее редко - реагентное умягчение. Метод основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
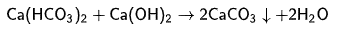
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения:
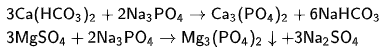
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
