

Одним из важнейших показателей качества волы является водородный показатель (рН воды). Вода, являясь слабым электролитом, частично диссонирует в воде на ионы.
H2O = 2 H+ + O2-
|
|
 Понятие рН воды было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogenii — сила водорода, или pondus hydrogenii — вес водорода. Присутствие ионов водорода и гидроксила даже в очень небольших концентрациях существенно влияет на свойства воды и водных растворов. Для оценки количества водородных ионов используют водородный показатель, или рН воды. Таким образом, рН – это мера активности ионов водорода в растворе, которая количественно выражает его кислотность. От величины pH зависит скорость протекания различных химических реакций, уровень коррозионной агрессивности воды, форма присутствия загрязняющих веществ в воде, что, в конечном счете, в ряде случаев, будет определять степень их токсичности.
Понятие рН воды было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogenii — сила водорода, или pondus hydrogenii — вес водорода. Присутствие ионов водорода и гидроксила даже в очень небольших концентрациях существенно влияет на свойства воды и водных растворов. Для оценки количества водородных ионов используют водородный показатель, или рН воды. Таким образом, рН – это мера активности ионов водорода в растворе, которая количественно выражает его кислотность. От величины pH зависит скорость протекания различных химических реакций, уровень коррозионной агрессивности воды, форма присутствия загрязняющих веществ в воде, что, в конечном счете, в ряде случаев, будет определять степень их токсичности.
рН воды рассчитывается как десятичный логарифм от концентрации ионов водорода в воде.
В зависимости от значения рН водный раствор можно разделить на нейтральный, кислотный и щелочной. На рисунке представлена шкала рН.
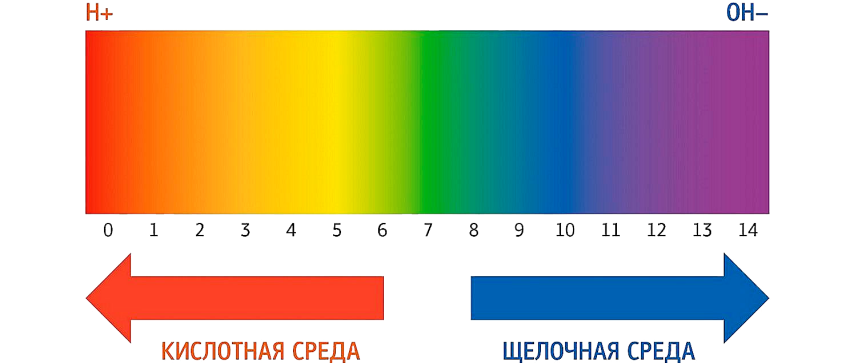
В нейтральной среде концентрация ионов водорода равна 1×10-7 моль/л, таким образом рН дистиллированной равен 7. Наличие в воде растворенного электролита меняет рН среды в соответствии с концентрацией ионов водорода или гидроксил анионов. Проще говоря, избыток ионов H+ определяет кислотные свойства раствора, в то время как избыток ионов ОН- определяет основные свойства раствора. Регулируя концентрацию этих ионов, мы можем управлять химическими и биохимическими процессами. Например, в пищевой промышленности это: брожение капусты, скисание молока, формирование простокваши, изготовление вина или пива.
Таким образом, в соответствии с уровнем рН воду можно разделить на несколько типов:
|
Тип среды |
Значение рН |
|
Сильнокислотная |
< 3 |
|
Кислая |
3–5 |
|
Слабокислотная |
5–6,5 |
|
Нейтральная |
6,5–7,5 |
|
Слабощелочная |
7,5–8,5 |
|
Щелочная |
8,5–9,5 |
|
Сильнощелочная |
> 9,5 |
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной.
2. Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в основную.
3. Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно.
4. Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется и для характеристики кислотно-основных свойств различных биологических сред. Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание необходимого рН является задачей исключительной важности.
В человеческом организме в различных органах водородный показатель различен. Нормальный уровень pH крови составляет 7,36, т.е. кровь имеет слабоосновную реакцию. Нормальный водородный показатель желудочного сока равен 1,5-2 ед. Вода с рН 6,5–8,5 является наиболее приемлемой для употребления.
